(一)技术领域
本发明涉及一种氯代有机污染物或其混合物的电化学氢化脱氯方法, 具体涉及电化学氢化带有羧基、羟基等弱酸性基团的氯代有机污染物上的 氯取代基的方法。
(二)背景技术
氯代有机污染物是一类重要的难降解有机化合物,其对生物体和环境 都有非常大的危害性。多数氯代有机物为人工合成产物,化学性质非常稳 定,其分子上氯原子的存在对微生物具有毒性,所以在自然界中降解缓慢, 危害周期长。氯代有机物的毒性主要是源于其氯原子的引入,而氯原子具 有较高的电负性,随着氯取代基的增多,亲电反应的难度增加,其生物降 解性大大降低。如将其中的氯原子脱除,生成毒性较低的芳烃或烷烃类物 质,则可通过后续的生物法彻底处理或作为工业原料回收。常见的脱氯技 术包括催化加氢脱氯、零价态金属还原脱氯、生物脱氯和电化学脱氯。其 中,钯催化的电化学氢化脱氯技术在常温常压下即可进行,具有脱氯过程 电位低、完全脱氯性能好等特点,从而成为近年来高效快速脱氯方向的研 究热点。
大部分氯代有机污染物都存在于自然界(比如水体和土壤中)或工业 废水中。根据常规思路,原位处理这些氯代有机污染物会具有设备投资少 (不需要富集设备)、操作成本低(不需要富集步骤)的优点。因此,据 我们所知,目前为止所有的钯催化的电化学氢化脱氯研究都从原位处理角 度出发,试图在低底物浓度和(或)低支持电解质浓度的条件下实现高效 脱氯[Sep.Purif.Technol.,2010,72:133-139;J.Solid State Electrochem., 2011,15:493-501;Appl.Cata.B:Environ.,2012,111-112(12):628-635; Water Res.,2013,47(11):3573-3582;Electrochim.Acta,2014,129:433-440; Chem.Eng.J.,2014,241(1):433-442;J.Hazard.Mater.,2015,290(15):1-8; Chemosphere,2015,125:57-63]。遗憾的是,所有这些研究都没能完全解 决如下三个在实际应用中必需解决的关键问题:电流效率很低、电流密度 很小和电解电压很高。
(三)发明内容
本发明目的是提供一种氯代有机污染物电化学氢化脱氯方法,以钯修 饰的导电材料为阴极,在加有足够支持电解质的水溶液中,对各种氯代有 机污染物在高浓度条件下进行电解反应,各种氯代有机物污染物都能实现 高效率的脱氯(高电流效率、高电流密度和低电解电压)。另外,分别以 Hastelloy C镍合金和泡沫镍载钯或银网载钯为阳极和阴极,在pH=12~14 的水溶液中,多种氯代有机污染物能在无隔膜条件下实现高效、高选择性 地脱氯。本发明能解决现有钯催化电化学脱氯技术钯利用率低、电流效率 很低、电流密度很小和电解电压很高等问题。
本发明采用的技术方案是:
本发明提供一种氯代有机污染物电化学氢化脱氯的方法,所述的方法 为:将式(I)所示的氯代有机污染物加入碱性溶液中得到电解反应液, 在以钯金属修饰的导电材料为阴极、以化学惰性导电材料为阳极的无隔膜 电解槽中进行电解反应,温度为0~100℃,电流密度为1~20A/dm2,电压 2.4~4.4V,pH=9~14,电解反应结束后,获得含式(II)所示脱氯化合物 的电解液,将电解液分离纯化,得到式(II)所示脱氯化合物;所述的碱 性溶液是由水和支持电解质混合配制而成,所述的支持电解质为无机碱或 有机碱中的一种或两种及以上任意比例的混合;
XRCln XRHn
(I) (II)
式(I)中,R为单苯环或单吡啶环或C1~C4烷基;X为羧基或羟基, n为1~5之间的正整数之一;式(II)中R、X和n同式(I)。
进一步,所述电解反应液中式(I)所示氯代有机污染物的浓度为 100~500g/L,优选190~220g/L。
进一步,式(I)所示氯代有机污染物为下列之一或两种及以上任意 比例的混合:氯代乙酸、氯代苯酚、氯代苯氧乙酸或氯代吡啶甲酸。
进一步,所述含式(I)所示的氯代有机污染物为下列之一或两种及 以上任意比例的混合:4-氯苯酚钠、2-氯苯酚钠、2,4,6-三氯苯酚钠、2,3,5,6- 四氯苯酚钠、五氯苯酚钠、2,4-二氯苯酚钠、2,4-二氯苯氧乙酸钠、3,6- 二氯吡啶甲酸钠和二氯乙酸钠,更优选所述含式(I)所示的氯代有机污 染物为下列组合之一:(1)2-氯苯酚钠与2,4-二氯苯酚钠、2,4,6-三氯苯酚 钠、2,3,5,6-四氯苯酚钠和五氯苯酚钠以质量比1:1.2:8.8:1.7:1.9的混合; (2)2,4-二氯苯酚钠与2,4-二氯苯氧乙酸钠、3,6-二氯吡啶甲酸钠和二氯 乙酸钠以质量比1:1.3:1.2:1.6的混合。
本发明所述的导电材料为下列之一:铁、钴、镍、铜、银、钛、石墨、 碳纤维毡或含碳导电塑料。所述导电材料还可以为导电聚合物修饰的导电 材料,所述导电聚合物为聚吡咯,所述聚吡咯是将0.01~0.1mol/L吡咯 单体在硫酸或盐酸水溶液中经阳极氧化或氧化剂氧化制备而成。所述钯金 属的质量负载量为0.1~10g/m2导电材料,优选为0.5~2g/m2。所述阴极形 状为板状、杆状、导线状、筛网状、网状、泡沫状、羊毛状或片状,优选 扩展的筛网状。更优选所述阴极为钯修饰的扩展银筛网(1g pd/m2)、钯 修饰的铁网(1g pd/m2)、钯修饰的钴网(1g pd/m2)、钯修饰的泡沫镍(1g pd/m2)、钯修饰的泡沫铜(5g pd/m2)、钯修饰的碳纤维毡(10g pd/m2)、 钯修饰的石墨板(1g pd/m2)、钯修饰的含聚吡咯的石墨板(0.1g pd/m2)、 钯修饰的含碳导电塑料板(1g pd/m2)或钯修饰的钛网(1g pd/m2)。
本发明导电材料上修饰钯的工艺是公知的,例如铁、钴、镍、铜、银 等活性金属可以用化学置换法修饰钯;钛、石墨、碳纤维材料、导电塑料 或者修饰了导电聚合物的上述导电材料可以用电沉积法修饰钯。
进一步,所述的支持电解质为氢氧化钠、氢氧化钾、氢氧化锂、氢氧 化铵、碳酸钠、碳酸钾、碳酸锂、四甲基氢氧化铵、四乙基氢氧化铵或四 丙基氢氧化铵中的一种或两种及以上任意比例的混合物,所述混合物优选 氢氧化钠和氢氧化钾以物质的量之比1:1的混合或氢氧化钠、氢氧化钾和 氢氧化锂以物质的量之比1:1:1的混合;所述的支持电解质在电解液中的 浓度为0.1~1.0mol/L。
本发明所述阳极可以是任何化学惰性导电材料或合金,如铂、石墨、 导电塑料、镍合金(如:Hastelloy C)或不锈钢之类的合金。阳极还可由 涂覆到另一种材料上的涂层组成,例如:将诸如氧化钌之类的贵金属氧化 物涂布到钛金属上。优选Hastelloy C镍合金作为阳极。
所述阳极的形状可以是板状、杆状、导线状、筛网状、网状、泡沫状、 羊毛状或片状的形式,优选扩展的筛网状。
本发明所述的电解反应可间歇进行或以连续或半连续方式进行。电解 槽可以是含有电极的搅拌槽或任何传统设计的流动电解槽。电解槽可以是 单室槽也可以隔膜电解槽,优选无隔膜的单室槽。
虽然优选放出氧气作为阳极反应,但是也可以使用许多其他的阳极反 应。包括氯分子和溴分子的放出或通过诸如甲酸盐或草酸盐之类的保护性 物质的氧化来产生二氧化碳或者通过有机反应物的氧化来形成有价值的 副产物。
本发明所述的电解反应过程中,相对于Ag/AgCl(3.0M KCl)参比电极 阴极电势为-0.6~-1.4V,优选-0.8~-1.2V;对应的电流密度根据电解反应 液中氯代有机污染物的浓度变化而变化,通常适合的电解阴极电流密度为 1~20A/dm2,优选5~10A/dm2。
本发明所述的电解反应温度优选20~40℃;优选pH控制在13~14。
本发明通过本领域公知的技术进行所需的电解还原。一般地,将原料 氯代有机污染物或其混合物溶解或者部分溶解于溶剂中,加入一定量的支 持电解质,然后在电解池中通入足够的电流,直到得到所需程度的还原, 电解反应结束后,通过进一步pH调节反应液并利用传统的技术回收产品, 比如酸析过滤或者化学萃取等。
本发明所述的选择性电化学还原中所涉及的反应(以氯代苯酚为例):
(1)中和反应:

(2)阴极反应:

(3)阳极反应:
2n OH-→1/2n O2+2n e-
(4)总反应:

本发明的有益效果主要体现在:本发明提供的氯代有机污染物电化学 氢化脱氯的方法,同时实现高电流效率(≥80%)、高电流密度(5~10 A/dm2)、低电解电压(≤3.5V)和不使用隔膜。这不仅能极大减少催化 剂钯的用量(降低至原位处理的1/100)和减小电解槽的体积,还能简化 电解槽结构、降低电解槽成本和降低电解能耗(降低至原位处理的1/2左 右)。
(四)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围 并不仅限于此:
本发明实施例所述阴极材料的制备方法参照[Electrochim.Acta,2012 69:389-396]。
实施例1钯催化4-氯苯酚钠电化学氢化脱氯成苯酚
无隔膜电解槽中,钯修饰的扩展银筛网为阴极(1g Pd/m2),Hastelloy C 276镍合金网为阳极,阴阳极间距离为0.5cm。1000mL 1mol/L NaOH+ 250克4-氯苯酚钠的水溶液为电解液。电解过程中,温度控制为20~25℃, 电流密度控制为10A/dm2,电解电压为2.8~3.2V,阴极液pH控制在 13.5~14,阴极电位为-0.8~-1.2V vs.Ag/AgCl(3.0M KCl)。通入2F/mol 4- 氯苯酚钠电量后停止电解。把阴极液转移到烧杯中后,加入硫酸调节 pH=4,然后用高效液相分析苯酚的收率为95%,电流效率为95%。
高效液相分析条件为:C18对称柱(250mm length_4.6mm i.d.,5mm particle size)为分离柱;含有30mM磷酸的乙腈/甲醇/水(体积比1:3: 6)混合溶液为流动相;流速为:1mL/Min;检测波长为230nm;Waters 2996PDA为检测器。
实施例2钯催化氯代苯酚混合物电化学氢化脱氯成苯酚
无隔膜电解槽中,钯修饰的扩展银筛网为阴极(1g Pd/m2),Hastelloy C 276镍合金网为阳极,阴阳极间距离为0.5cm。1000mL 1mol/L NaOH +15克2-氯苯酚钠+18.5克2,4-二氯苯酚钠+131.6克2,4,6-三氯苯酚钠 +25.4克2,3,5,6-四氯苯酚钠+28.9克五氯苯酚钠的水溶液为电解液。电解 过程中,温度控制为20~25℃,电流密度控制为10A/dm2,电解电压为 2.8~3.3V,阴极液pH控制在13.5~14,阴极电位为-0.8~-1.2V vs.Ag/AgCl (3.0M KCl)。通入200AH的电量后停止电解。把阴极液转移到烧杯中后, 加入硫酸调节pH=4,然后用高效液相分析苯酚的收率为100%,电流效 率为80.4%。
实施例3钯催化2,4-二氯苯酚钠、2,4-二氯苯氧乙酸钠、3,6-二氯吡 啶甲酸钠、二氯乙酸钠混合物电化学氢化脱氯成苯酚、苯氧乙酸、吡啶甲 酸和乙酸
无隔膜电解槽中,钯修饰的扩展银筛网为阴极(1g Pd/m2),Hastelloy C 276镍合金网为阳极,阴阳极间距离为0.5cm。1000mL 1mol/L NaOH +37克2,4-二氯苯酚钠+48.8克2,4-二氯苯氧乙酸钠+43克3,6-二氯吡啶甲 酸钠+60.4克二氯乙酸钠的水溶液为电解液。电解过程中,温度控制为 20~25℃,电流密度控制为10A/dm2,电解电压为2.9~3.4V,阴极液pH 控制在13.5~14,阴极电位为-0.8~-1.2V vs.Ag/AgCl(3.0M KCl)。通入 120AH的电量后停止电解。把阴极液转移到烧杯中后,加入硫酸调节 pH=4,然后分别用高效液相和离子色谱分析苯酚、苯氧乙酸、吡啶甲酸 和乙酸的收率。四种目标产物的收率都为100%,脱氯电流效率为89%。
高效液相条件:C18对称柱(250mm length_4.6mm i.d.,5mm particle size)为分离柱;含有30mM磷酸的乙腈/甲醇/水(体积比1:3:6)混合 溶液为流动相;流速为:1mL/Min;检测波长为230nm;Waters 2996PDA 为检测器。
离子色谱条件:IonPac AS 19阴离子交换柱(4×250mm)为分离柱; 洗脱梯度程序为:0→5min(10mM KOH),5→20Min(10→40mM KOH);流速为:1mL/Min;仪器型号为:Dionex ICS-2000)。
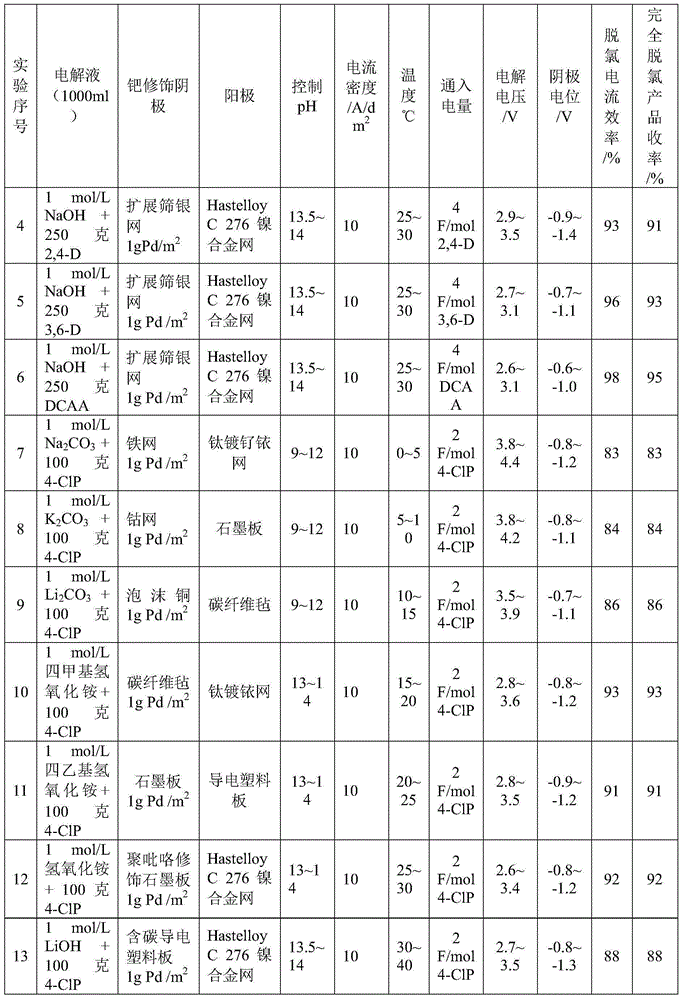
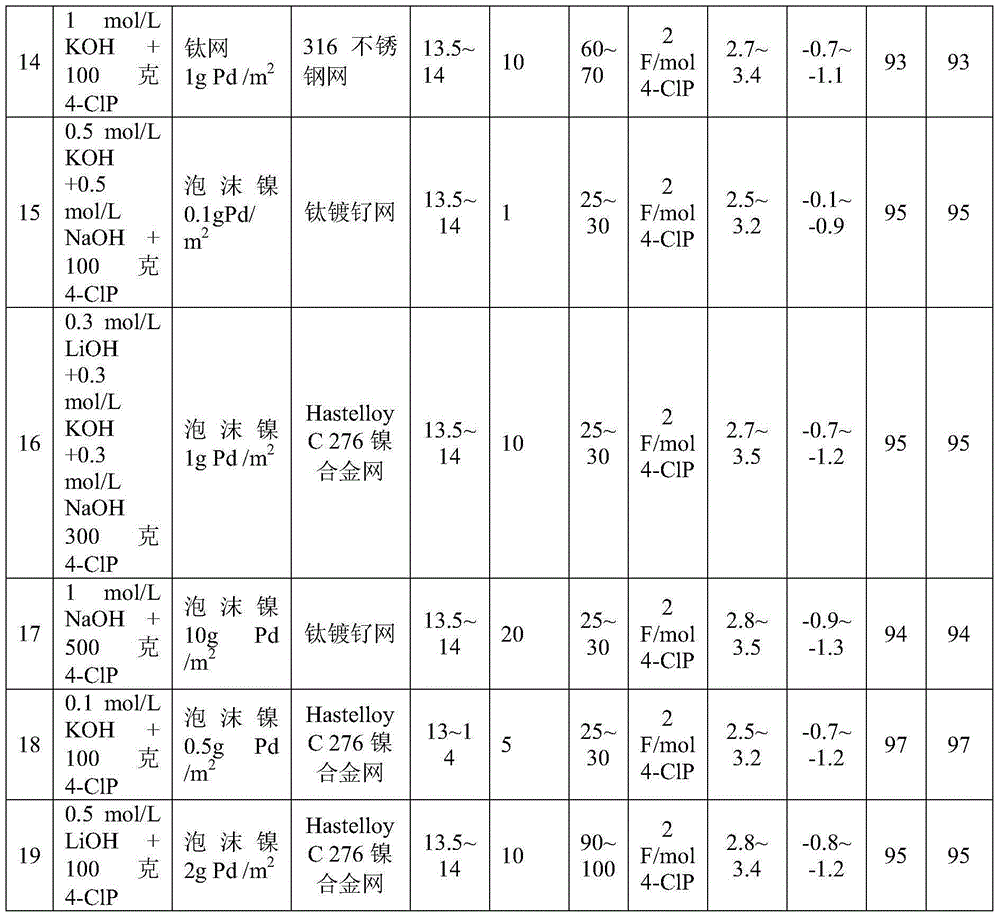
实施例4~实施例19
实施例4~实施例19依照表1的实验参数进行,其余操作同实施例1。 2,4-二氯苯氧乙酸、3,6-二氯吡啶甲酸、二氯乙酸、4-氯苯酚分别用2,4-D、 3,6-D和DCAA、4-ClP表示。
表1 实施例4~实施例19实验条件及结果
比较例1原位条件下钯催化4-氯苯酚钠电化学氢化脱氯成苯酚
隔膜电解槽中,钯修饰的扩展银筛网为阴极(1g Pd/m2),钛镀铱网 为阳极,全氟磺酸膜为隔膜,阴阳极间距离为0.5cm。1000mL 10mmol/L Na2SO4+1克4-氯苯酚的水溶液为阴极液,0.5mol/L硫酸水溶液为阳极 液。电解过程中,温度控制为20~25℃,电流密度控制为0.1A/dm2,电 解电压为4.8~5.2V,阴极液pH控制在2~5,阴极电位为-0.2~-0.8V vs. Ag/AgCl(3.0M KCl)。通入2F/mol 4-氯苯酚钠电量后停止电解。把阴极 液转移到烧杯中后,加入氢氧化钠调节pH=4,然后用高效液相分析苯酚 的收率为81%,电流效率为81%。
比较例2~比较例6(和实施例15~实施例19对比)
比较例2~比较例6依照表2的实验参数进行,其余操作同比较例1。 4-氯苯酚用4-ClP表示。比较例1~比较例6说明,原位电解处理氯代有机 污染物条件下(低底物浓度、低支持电解质、隔膜电解),无法得到理想 的电解结果(电解电压高、电流密度小)。
表2 比较例2~比较例6实验条件及结果


